前言
不孕症是全球性健康挑战,影响约17.5%的成年人口,约1.86亿人。其原因多样,包括男性和女性因素,如精子质量低、输卵管阻塞、子宫内膜异位症和多囊卵巢综合征等。约30-38%的病例原因不明。不孕症不仅带来医学问题,还对患者的心理和情感造成重大影响,如焦虑、抑郁和失望。辅助生殖技术(ART)是解决不孕症的重要手段,但目前仍面临诸多挑战。传统的ART方法,如体外受精(IVF)和胞浆内单精子注射(ICSI),依赖于手动操作,存在变异性和预测准确性不足的问题。近年来,生物工程和细胞生物学的进展为ART带来了新的机遇。微流控系统、合成基质和表面拓扑结构等微工程平台能够模拟自然生殖过程中的微环境,通过精确控制细胞行为和细胞外基质的物理性质,提高ART的成功率。本次分享荷兰马斯特里赫特大学 MERLN 仿生再生医学研究所Erik Vrij 课题组文章,该文详细探讨了微工程和干细胞技术在ART中的应用,特别是在精子选择、卵母细胞处理、胚胎培养和植入等关键步骤中的潜力。
微流控及干细胞技术在受精方面的应用
受精是一个复杂的过程,依赖于多个相互关联的生物学因素。精子的运动能力对于精子能够通过输卵管到达卵母细胞至关重要。卵母细胞的质量,包括染色体组成、细胞质成熟度、线粒体功能和DNA完整性等,同样重要。一旦受精成功,胚胎的质量成为关键因素,受精卵的细胞分裂速度、细胞紧密排列和囊胚形成等都会影响胚胎的发育。在ART中,最常用的两种受精技术是体外受精(IVF)和胞浆内单精子注射(ICSI)。这两种技术都涉及一系列关键步骤,包括卵巢刺激、卵母细胞采集、精子选择、胚胎培养和评估、胚胎冷冻保存、植入前遗传学检测(PGT)以及胚胎移植。尽管这些技术已经发展了数十年,但它们仍然依赖于手动操作,这可能会引入变异性和限制预测准确性。
为了克服这些挑战,研究人员正在探索自动化和精准化的解决方案。如微流控系统,可以模拟体内微环境,减少对配子和胚胎的机械应力,并自动化IVF程序。这些系统可以精确控制体积、细胞外基质(ECM)的物理性质,以及模拟原始组织的生化和功能特性。这些工具的应用可以减少ART治疗的成本,减少手动过程中的变异性和敏感性,同时保留配子和胚胎的内在质量,这对于成功结果至关重要。
精子选择和分选
传统的精子选择方法主要基于密度和运动能力,但这些方法可能会对精子细胞造成损伤,包括活性氧(ROS)的积累。微流控平台可以利用精子的趋性行为(如逆流、边界跟随、化学吸引和热趋性)来选择高质量的精子。这些平台不仅提高了精子的选择效率,还降低了DNA碎片化,简化了准备过程。例如,利用微流控芯片通过逆流选择运动能力强的精子,或者利用化学吸引剂(如卵泡细胞分泌的分子)引导精子,从而选择出具有更好遗传质量的精子。
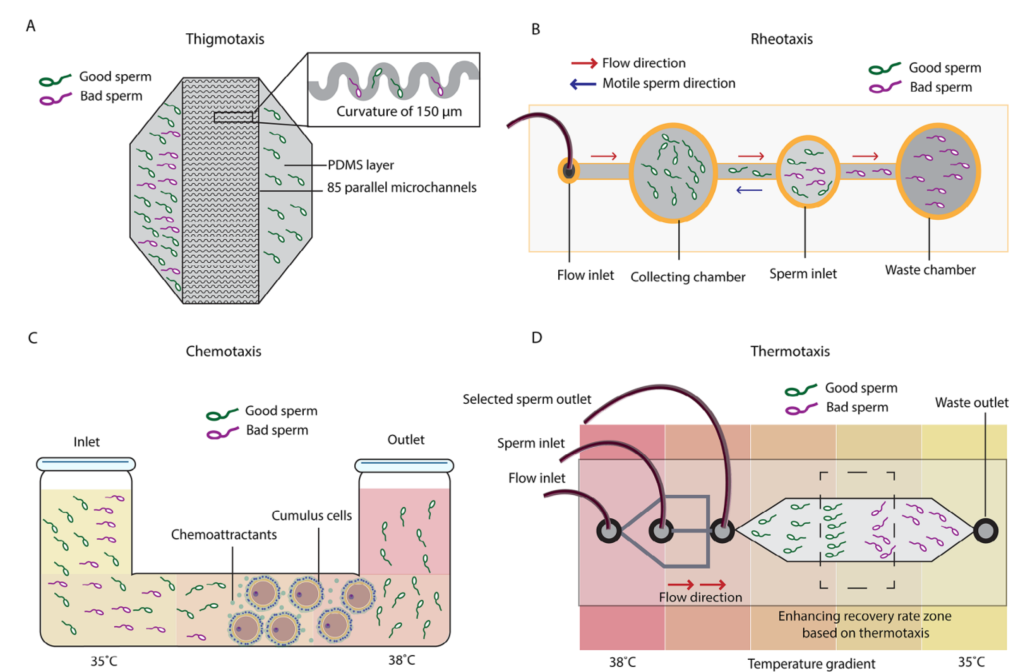
图1A:基于边界跟随行为的精子微流控芯片设计
该研究开发了具有85条平行微通道的芯片,通道曲率为150微米,用于选择高质量的精子。这种设计利用了精子的边界跟随行为,引导精子沿着通道壁移动,从而实现高质量精子的分离。
图1B:基于逆流行为的精子微流控芯片设计
这种简单的装置利用流动,根据精子逆流而上的能力选择高质量的精子。精子需要逆着流动方向游动,只有具有较高运动能力的精子才能到达收集区域。与静态条件相比,流动条件下精子的DNA碎片化更低,运动能力更强,形态更好。
图1C:基于化学趋性(和热趋性)的微流控芯片设计
在此设置中,将卵母细胞的卵泡细胞置于管内,释放化学吸引分子,引导精子向其移动。卵泡细胞分泌的分子(如孕酮)诱导精子的分子机制,引导精子向其移动。通过化学趋性引导的精子表现出更低的DNA碎片化,表明其染色质质量得到了更好的保护。
图1D:基于热趋性(和逆流行为)的微流控芯片设计
在此设置中,施加了温度梯度以创建一个增强恢复率区域。高质量的精子会向梯度中更理想的温度移动,随后通过流动进一步排序。通过热趋性选择的精子具有更好的运动能力和更高的质量,因为能够响应温度梯度的精子更有可能到达收集区域。
卵母细胞去颗粒细胞和冷冻保存
传统的卵母细胞去颗粒细胞方法(如使用透明质酸酶)可能会对卵母细胞造成机械损伤,降低受精和发育能力。冷冻保存过程中,细胞可能会受到冰晶形成、渗透压变化和毒性的影响。微流控平台可以精确控制去颗粒细胞的过程,减少对卵母细胞的损伤。在冷冻保存方面,微流控系统可以精确控制冷冻保护剂的加载,减少渗透压冲击,提高卵母细胞的存活率。
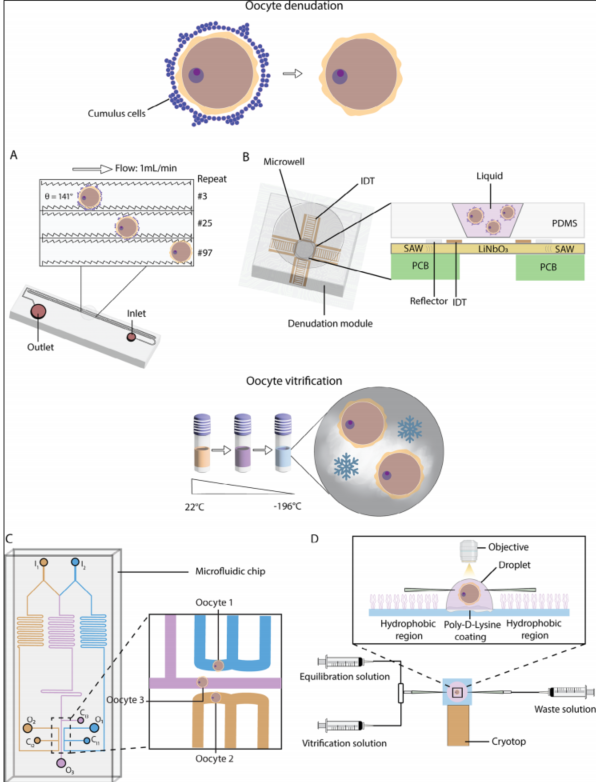
图2A:基于微流控的卵母细胞去颗粒细胞设备
该设备包含150个收缩-扩张单元,通道的宽度(几何形状)和表面(光滑或锯齿状)各不相同。通过连接到注射泵的管道将培养基引入入口,从而在通道中产生流动。去颗粒细胞后的裸卵母细胞从出口收集。与手动去颗粒方法相比,该微流控设备能够更高效地去除卵母细胞周围的颗粒细胞,同时减少对卵母细胞的机械损伤,提高后续受精和胚胎发育的成功率。
图2B:基于表面声波(SAW)的卵母细胞去颗粒细胞模块
该模块由一个微孔和四个对称排列的交错式换能器(IDTs)组成,这些换能器位于PDMS微孔设计中。通过声流和辐射力促进卵母细胞-颗粒细胞复合体(COCs)的去颗粒细胞过程。显著减少了去颗粒细胞的时间和劳动强度,同时保持了卵母细胞的完整性,且在不同处理组(20 MHz和200 MHz)中,卵母细胞的存活率、受精率和胚胎发育率与机械移液组相当。
图2C:用于研究卵母细胞渗透性的微流控灌注芯片
该芯片设计为一个蛇形通道,用于精确混合溶液并创建不同的浓度梯度,用于研究渗透性如何依赖于浓度。芯片上有多个卵母细胞入口和出口,可以同时研究多个卵母细胞在不同浓度下的渗透性。通过同时测量三个卵母细胞在相同的渗透压变化下的反应,提高了测量效率。此外,神经网络算法的应用提高了数据处理的准确性。该芯片还用于胚胎移植(ET)实验,以验证微流控方法是否对下游卵母细胞发育造成损害。
图2D:用于高效加载冷冻保护剂的微流控芯片
该芯片连接到冷冻顶(cryotop)和三个不同的注射器,用于通过微毛细管从两侧加载平衡液和冷冻保护液,以及一个用于废物的注射器。芯片由疏水表面和聚-D-赖氨酸(PDL)涂层表面组成,用于稳定含有卵母细胞的液滴。通过精确控制冷冻保护剂的加载过程,减少了卵母细胞在冷冻过程中受到的渗透压冲击。实验表明,与手动冷冻相比,使用微流控设备的卵母细胞在冷冻过程中体积缩小程度减少了6%,存活率得到了提高。
体外配子生成
外配子生成(IVG)是一种实验性技术,旨在通过体外培养将干细胞分化为成熟的配子(精子或卵母细胞)。这种技术结合了生殖医学和干细胞领域的研究,具有巨大的潜力。IVG技术理论上可以为LGBTQ+群体或单身父母提供生育机会。此外,它还可以为因癌症治疗或早衰导致不孕的女性提供长期解决方案。目前,IVG技术仍处于高度实验性阶段,但已取得了一些初步成果。例如,研究人员已经能够从人类诱导多能干细胞(hiPSCs)中分化出早期生殖细胞样细胞(PGCLCs),并进一步诱导其形成精子或卵母细胞。
PGCLCs的分化:
研究人员首先将多能干细胞(如胚胎干细胞或诱导多能干细胞)分化为原始生殖细胞样细胞(PGCLCs)。这一过程涉及多个分子机制,其中SOX17是一个关键的转录因子,它在人类PGCLCs的分化中起着重要作用。
配子生成
PGCLCs进一步分化为成熟的配子。例如,研究人员已经成功地从人类胚胎干细胞(hESCs)和诱导多能干细胞(hiPSCs)中分化出类似精子的细胞,并且这些细胞具有与人类精子相似的关键标记和基因印记。
卵母细胞生成
在卵母细胞方面,研究人员也取得了一些进展。例如,Jung等人在2017年从人类胚胎干细胞(hESCs)中分化出类似卵巢滤泡的细胞(FLCs),这些细胞在转录组分析、免疫染色和移植实验中显示出与原始滤泡相似的特征。
尽管IVG技术取得了一些进展,但仍面临许多挑战。例如,人类配子的发育和分化机制与小鼠模型存在显著差异,这使得研究更加复杂。此外,IVG技术需要精确控制细胞微环境,包括氧气水平、pH值和营养物质的可用性。
微流控技术和干细胞应用于胚胎发育
植入是生殖过程中的一个关键步骤,也是辅助生殖技术(ART)成功与否的决定性因素之一。植入过程涉及胚胎与子宫内膜之间的复杂相互作用,包括胚胎的附着、侵入和子宫内膜的接受性。由于植入过程在体内发生,且难以直接观察,因此被称为生殖学中的“黑箱”。
植入过程涉及多个生物事件:
胚胎与子宫内膜的接触:胚胎与子宫内膜腔上皮细胞的初始接触。
粘附:胚胎滋养层细胞与子宫内膜上皮细胞之间的粘附。
侵入:胚胎侵入子宫内膜基质和腺体上皮细胞。
蜕膜化:子宫内膜基质细胞的蜕膜化,为胚胎提供支持。
微工程工具,如微流控芯片和生物传感器,可以模拟体内环境,提供动态的培养条件,从而更好地研究植入过程。这些工具能够精确控制营养物质、激素和生长因子的供应,同时模拟子宫内的流体动力学。
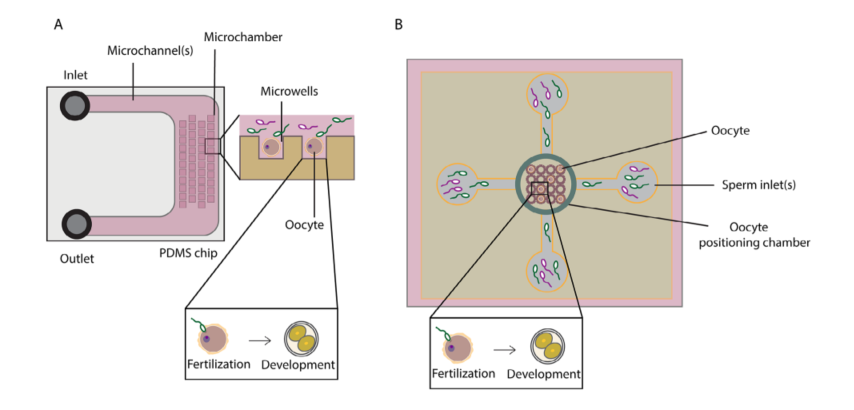
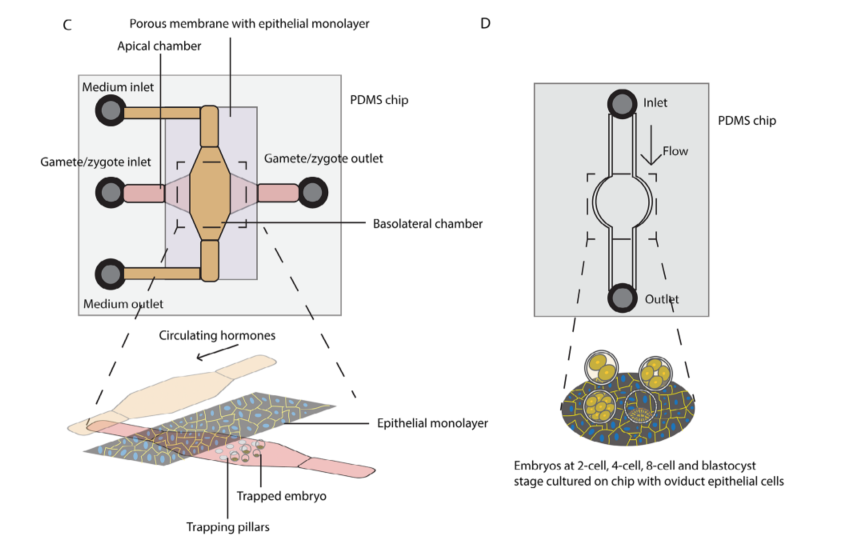
图3A:用于体外受精的微流控设计
设计特点:该芯片设计了一个集成的卵母细胞定位系统,用于捕获卵母细胞并进行受精。通过切换培养基,胚胎可以在芯片内发育至囊胚阶段。
优势:这种设计允许在同一个芯片内完成精子筛选、受精和胚胎培养,减少了操作步骤和对胚胎的机械应力,同时提供了更接近体内的动态培养环境。
图3B:用于卵母细胞捕获的简化微流控设计
设计特点:该芯片包含微孔,用于捕获卵母细胞。通过引入流动,可以更换培养基并清除杂质。
优势:这种简化的设计使得卵母细胞的捕获更加高效,同时减少了操作复杂性,适合大规模应用。
图3C:用于胚胎培养的微流控芯片设计
设计特点:该芯片设计用于模拟输卵管的微环境。芯片的顶部是一个多孔膜,上面种植了输卵管上皮细胞单层,为胚胎发育提供必要的分子。底部是一个基底室,提供流动,模拟激素循环。
优势:这种设计能够更好地模拟体内胚胎发育的微环境,提高胚胎培养的成功率。实验表明,与对照组相比,与输卵管上皮细胞共培养的胚胎囊胚率显著提高(71.8% ± 4.3% vs 54.6% ± 6.6%)。
图3D:用于胚胎培养的简化微流控芯片设计
设计特点:该芯片在培养室内预先种植了输卵管上皮细胞。通过连接管道,可以自动更换培养基。实验中,不同阶段的胚胎在芯片上培养,部分芯片包含上皮细胞,部分不含。
优势:这种设计通过精确控制培养环境,减少了对胚胎的机械应力,同时提供了更接近体内的动态培养条件。实验表明,与不含上皮细胞的芯片相比,含有上皮细胞的芯片培养的胚胎活性氧(ROS)水平更低,胚胎发育更好。
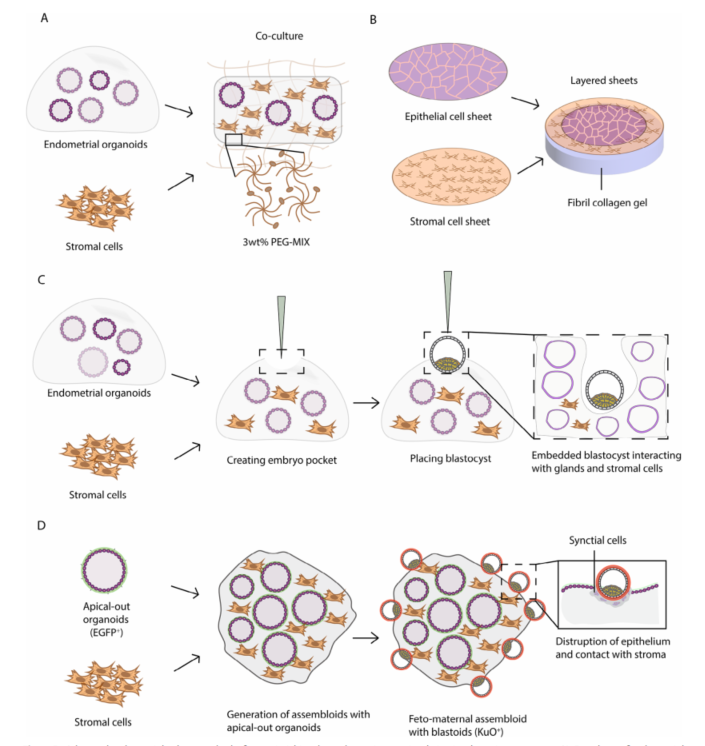
图4A:共培养子宫内膜类器官与基质细胞的PEG-MIX水凝胶
设计特点:该平台将子宫内膜类器官与基质细胞共培养在特制的PEG-MIX水凝胶中。这种水凝胶通过功能性肽段(如GFOGER和PHSRN-KRGD)模拟胶原蛋白和纤维连接蛋白的黏附位点。
优势:该系统能够模拟月经周期的不同阶段,上皮细胞对孕激素处理有反应,基质细胞表现出蜕膜化行为(如催乳素分泌增加)。这种设计为研究子宫内膜的生理过程和疾病模型提供了有力工具。
图4B:在纤维蛋白-胶原凝胶上共培养上皮细胞和基质细胞
设计特点:该研究将大鼠子宫内膜组织作为三维子宫内膜样片层培养在纤维蛋白-胶原凝胶上,形成具有上皮细胞和基质细胞的多层结构。
优势:细胞片层保留了自然的组织结构和细胞间直接相互作用,这对于模拟子宫内膜的生理条件至关重要,能够更好地支持组织功能和细胞响应。
图4C:共培养腺样结构和基质细胞以及胚泡
设计特点:该研究开发了腺样结构和基质细胞的共培养系统(称为“assembloids”),用于测试蜕膜衰老如何促进胚胎在子宫内膜中的植入。通过在assembloids中创建小囊袋来嵌入人类胚胎。
优势:该系统能够模拟胚胎与子宫内膜的相互作用,但存在局限性,如缺乏用于植入研究的子宫内膜腔上皮。
图4D:共培养子宫内膜类器官、基质细胞和胚泡
设计特点:该研究将子宫内膜类器官(AO-EMO)、基质细胞和人脐静脉内皮细胞(HUVEC)共培养,形成能够响应激素的assembloids模型。将胚泡与这些assembloids共培养5天,展示了胎母界面的事件,包括可能的细胞融合。
优势:该系统能够更全面地模拟胚胎植入过程,包括胚胎与子宫内膜的相互作用,为研究胚胎植入和早期妊娠提供了有力工具。
结论:
微流控和干细胞技术在辅助生殖技术(ART)中的应用显示出巨大的潜力,尤其是在精子选择、胚胎培养和植入模拟方面。这些技术能够模拟体内环境,减少对配子和胚胎的机械应力,提高ART的成功率。通过跨学科合作、技术优化和伦理法规的更新,这些技术有望在未来的生殖医学中发挥重要作用,为患者提供更有效、更个性化的治疗方案。
参考文献:
Ak, A., Coonen, E., van Golde, R., & Vrij, E. (2025). Integration of Bioengineered Tools in Assisted Reproductive Technologies. Advanced Healthcare Materials. https://doi.org/10.1002/adhm.202500918